Inwiefern beeinflussen pH-Wert, elektrische Leitfähigkeit und Sauerstoffkonzentration des Füllwassers das elektrochemische Korrosionsgeschehen?
- Seite 1
- Seite 2
Korrosion in Heizkreisläufen
Das elektrochemische Phänomen einmal anschaulich erklärt
Dienstag, 11.04.2017
Jeder Fachhandwerker weiß, dass das Heizungswasser für den langfristig sicheren Betrieb moderner Heizungsanlagen immer wichtiger wird. Dies ist auch aus den aktuellen Regelwerken herauszulesen. Allerdings herrscht noch immer eine gewisse Verunsicherung darüber, mit welcher Aufbereitungs- bzw. Behandlungsmethode – enthärten, entsalzen, inhibieren – die optimale Füllwasserqualität möglichst nachhaltig erreicht werden kann. Dieser Fachbeitrag zeigt anhand eines einfachen elektrischen Schaltbildes, inwiefern pH-Wert, elektrische Leitfähigkeit und Sauerstoffkonzentration des Füllwassers das elektrochemische Korrosionsgeschehen beeinflussen.
Sauerstoff gilt im Heizungswasser als Korrosionstreiber Nummer eins. Tatsächlich hängen die Korrosionsraten der meisten im Heizkreislauf verbauten Metalle direkt von der Menge an gelöstem Sauerstoff ab. Das heißt: Sofern ein Sauerstoffzutritt sicher vermieden werden kann, findet meist keine Korrosion statt. Dies gilt allerdings nicht für niedrige pH-Werte < 6 oder, im Falle von Aluminium, für pH-Werte > 8,5. Für die Säurekorrosion sowie für die Basenkorrosion ist kein Sauerstoff erforderlich, um den "Korrosions-Stromkreis" zu schließen.
Zur einfachen Veranschaulichung lassen sich die Abläufe im Korrosionsgeschehen auf einen Stromkreis übertragen, wie er noch aus dem Schulunterricht bekannt sein dürfte. Wie die folgende Abbildung schematisch zeigt, besteht dieser aus Stromquelle, Glühlampe, Schalter und ggf. elektrischem Widerstand.
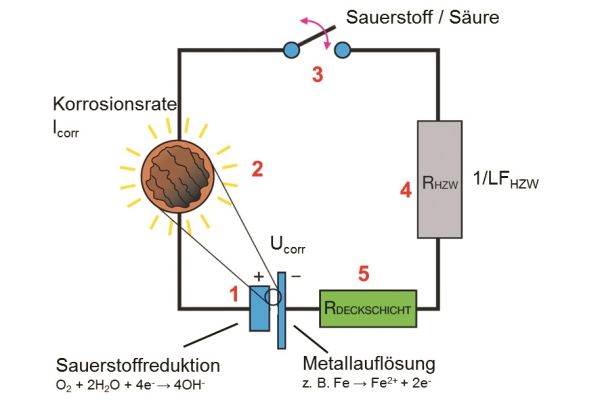
Die Korrosionsreaktion entspricht dabei der Stromquelle (1), die Leuchtkraft der Glühlampe (2) zeigt die Korrosionsgeschwindigkeit. Ob der Schaltkreis geschlossen ist oder nicht, entscheidet das Vorhandensein von Sauerstoff oder Säure im Heizwasser, im Schaubild dargestellt mit dem Schalter (3). Nun wird die Leuchtkraft der Glühlampe unter anderem noch beeinflusst von den beiden Widerständen (4+5). Ein Widerstand ist dabei dem Heizungswasser zugeordnet, der andere einer möglichen Deckschicht auf dem Metall.
Das kleine Korrosions-Einmaleins
Damit die Einflüsse von pH-Wert und Leitfähigkeit auf die mögliche Korrosionsreaktion deutlicher werden, sind die einzelnen Komponenten im Stromkreis näher zu betrachten:
- Die Spannung der Stromquelle und damit die mögliche Leuchtkraft der Glühlampe hängt direkt ab von den chemischen Reaktionen am Plus- und Minuspol. Jede Reaktion erzeugt ein gewisses Potential und die Potentialdifferenz zwischen beiden Polen bestimmt die Spannung der Stromquelle.
Dort, wo das Metall in Lösung geht (z.B. Fe ⇑ Fe2+ + 2 e-) befindet sich der (-)Pol. An der anderen Elektrode, dem (+)Pol, wird der im Wasser gelöste Sauerstoff reduziert, also gemäß der chemischen Formel O2 + 2 H2O + 4 e- ⇑ 4 OH- verbraucht, oder Säure (H+) zu Wasserstoff entladen. Wichtig ist da-bei: Die Reaktion am (+)Pol ist abhängig vom pH-Wert und liefert mit abnehmendem pH-Wert mehr "Spannung" (59 mV/pH). Niedrige pH-Werte beschleunigen auch aus diesem Grund die Korrosion.
-
Die Helligkeit der Glühlampe zeigt direkt die Korrosionsgeschwindigkeit an und hängt davon ab, ob der Schalter geschlossen ist und wenn ja, wie viel Strom fließt.
-
Der Schalter wird im Heizkreis entweder durch das Vorhandensein von Sauerstoff oder durch Säuren bei pH-Werten < 6 geschlossen. Bei einer korrosionstechnisch geschlossenen Anlage mit einem pH-Wert von 8,2 im Kreislaufwasser wäre der Schalter also geöffnet und es könnte demnach keine Korrosion stattfinden.
-
Wieviel Strom fließen kann, hängt neben der Spannung der Stromquelle auch von möglichen Widerständen im Stromkreis ab. Einen starken Einfluss übt hier die elektrische Leitfähigkeit des Heizungswassers aus. Eine niedrige Leitfähigkeit entspricht einem hohen Widerstand. Eine salzarme Betriebsweise begrenzt somit die mögliche Korrosionsgeschwindigkeit enorm.
-
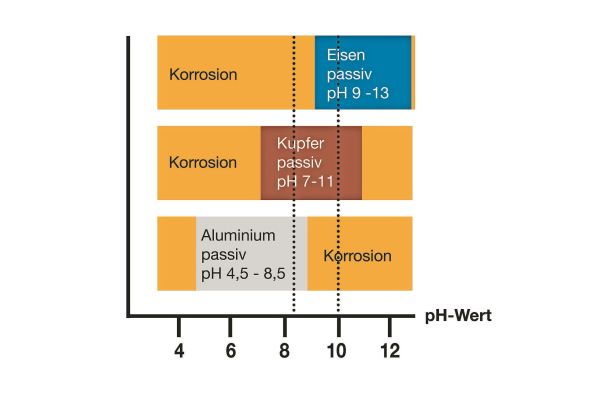
Bildet sich auf den im Heizkreis verbauten Metallen eine Deckschicht aus, tritt ein weiterer Widerstand hinzu. Ob sich Deckschichten ausbilden können oder nicht, bestimmt maßgeblich der herrschende pH-Wert. Daher empfehlen auch die Richtlinien* einen pH-Bereich von 8,2 bis 10. Aluminium besitzt diese dichte Deckschicht bereits von Anfang an. Alkalische pH-Werte > 8,5 lösen diese dichte Schutzschicht leicht ab (* Richtlinien EU, D, CH, A: DIN EN 14868, VDI 2035-2, SWKI BT 102, ÖNORM H 5195-1):
Grundsätzlich lässt sich auch durch Hinzugabe eines Korrosionsinhibitors eine Schutzschicht erzeugen und dieser Widerstand vergrößern. Allerdings sollte diese chemische Methode – nicht zuletzt auch aus Gründen der erforderlichen Überwachung – nur in Ausnahmefällen erwogen werden, sofern ein Sauerstoffeintrag technisch nicht anders zu vermeiden ist.
Es zeigt sich deutlich, dass bei einem hohen Widerstandswert des Heizungswassers ein möglicher Widerstand (5) der Deckschicht zunehmend an Bedeutung verliert. Dadurch können bei salzarmer Betriebsweise auch eher Abweichungen im pH-Wert toleriert werden und es kann auf Inhibitoren verzichtet werden.











