
Korrosionsprobleme mit Frostschutzmittelresten
Die gezielte Zugabe von Frostschutzmitteln stellt in der Regel kein Problem dar, weil hier auf Mindestkonzentrationen geachtet wird und die Fertigmischungen auch entsprechende Schutzstoffe wie Korrosionsinhibitoren und Pufferungsmittel enthalten. Als problematisch erweisen sich vielmehr unbeabsichtigt eingebrachte Kleinmengen im Bereich von < 0,5 %. Primäre Quellen dafür sind Spülpumpen und Schläuche, die gleichzeitig für das Füllen thermischer Solaranlagen genutzt werden. Daneben werden auch zur Dichtheitsprüfung mancher Aggregate, z.B. Wärmepumpen, Glykole benutzt, die vor der Installation ausgespült werden müssten. Ethylenglykol, oder das aus gesundheitlicher Sicht ungefährlichere Propylenglykol sind zunächst vom pH-Wert her neutral. Kommen aber diese zweiwertigen Alkohole in der Hitze in Gegenwart von Eisenionen mit etwas Sauerstoff in Kontakt, bauen sie sich zu organischen Säuren ab. Eisenionen beschleunigen dabei die Degradation erheblich, während Kupfer, Messing und Aluminium keine alterungsfördernde Wirkung zeigen. Als Reaktionsendprodukte sind v. a. Essigsäure, aber auch Oxal-, Milch-, und Glykolsäure nachweisbar, die den pH-Wert stark absenken. Auch die aktuelle VDI-Richtlinie 2035 hat dies in Kapitel 10/Tab. 2 aufgegriffen und nennt als Ursache für orangefarbene Heizungswässer mit niedrigem pH-Wert die organischen Säuren aus verschleppten, bereits abgebauten Frostschutzmitteln. Gefolgt von der Empfehlung, Komponenten, die bereits für Wasser-Frostschutzmittel-Befüllungen genutzt wurden, nicht weiter für die Heizungsanlage einzusetzen.
Reste von Frostschutzmitteln sind eine Quelle für organischen Kohlenstoff und somit ein relevanter Wasserparameter, der mikrobiologische Prozesse ermöglicht. Organischer Kohlenstoff ist unter anderem auch für die Sulfatreduktion notwendig, die entstehenden Schwefelspezies wirken z.B. stark korrosiv auf Stahl. Als Messgröße ist hier der TOC-Gehalt (total organic carbon) zu nennen, Regelwerke wie die BTGA 3.003 oder die Schweizer SWKI BT102 geben hier Richtwerte von < 25 bzw. < 30 mg/l vor. Belastete Anlagen im Feld zeigen oft Werte bis 2000 mg/l.

Welche Sanierungsmöglichkeiten gibt es?
In einem so hohen Ausmaß belastete Anlagen sollten, wenn möglich, erst mit Leitungswasser quergespült werden, danach wäre als Mittel der Wahl eine Aufbereitung im Teilstromverfahren zu empfehlen. Sofern das Anlagenwasser betriebsbedingt oder aufgrund entsprechender Einleitgrenzwerte nicht einfach abgelassen oder vorher gespült werden kann, so lässt sich zur Sanierung des Anlagenwassers die Teilstromaufbereitung auch direkt einsetzen. In diesem Falle sollte das Anlagenwasser weitgehend entsalzt werden (LF < 60 µS/cm), um dessen Pufferung zu vermindern und nebenbei das gelöste Eisen zu entfernen. Findet eine solche Entsalzung nicht statt, wird spätestens bei der pH-Korrektur nach oben viel Eisen(III)oxidhydrat (FeOOH) als Schlamm ausfallen und ggf. Filter verblocken. In einem weiteren Arbeitsschritt sind die degradierten Rückstände des Glykols, z.B. durch intensive Teilstromfiltration über Aktivkohle, bestmöglich zu eliminieren. Andernfalls darf davon ausgegangen werden, dass sich der pH-Wert im Laufe der Zeit erneut absenken wird. Abschließend wird ein alkalisierender pH-Stabilisator eingespült. Alle Arbeitsschritte lassen sich zum Beispiel sehr einfach mit der multifunktionalen, kompakten Teilstromentsalzungseinheit „permaLine mobil“ ausführen. Voraussetzung für den Verfahrenserfolg ist immer das Erfassen des kompletten Anlagenvolumens.
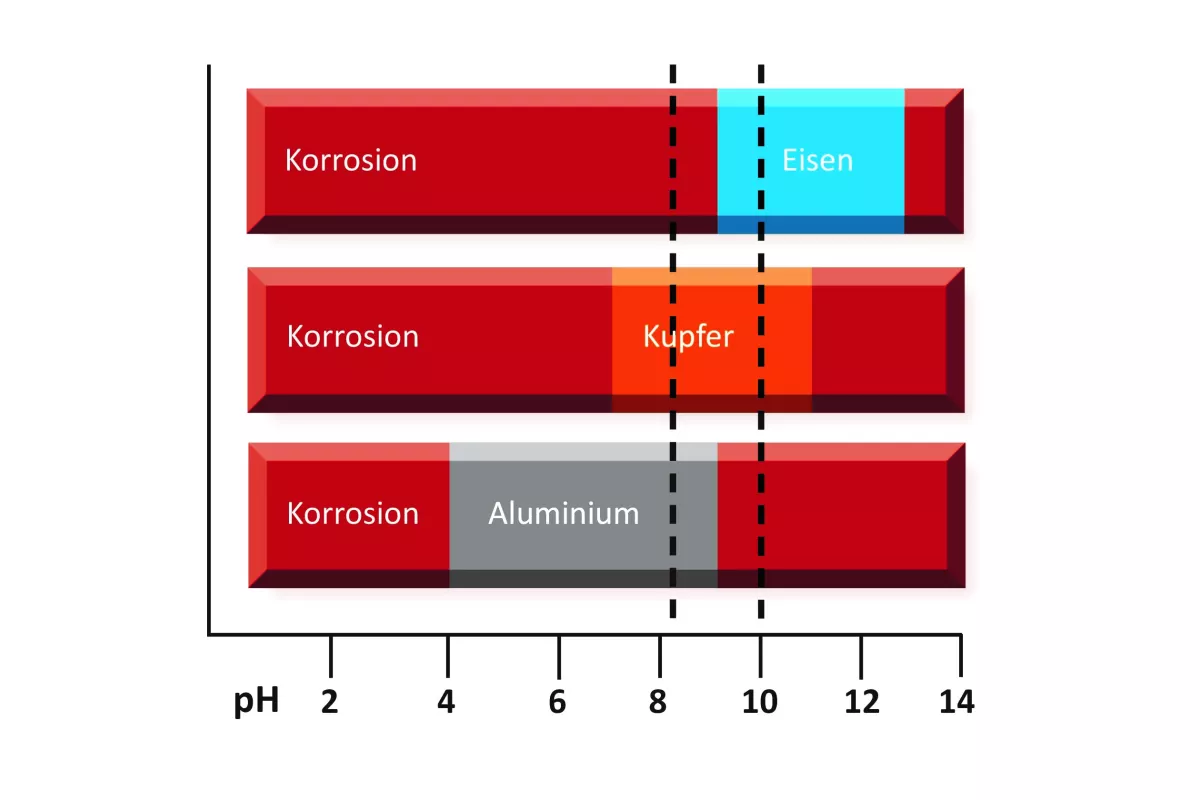
Wissenswertes zum pH-Wert
Der pH-Wert gibt an, ob eine Lösung sauer (pH < 7), neutral (pH 7,0) oder basisch (pH > 7) reagiert. Die Skala reicht im wässrigen Bereich von 0-14, die Größe ist dimensionslos. Für das Korrosionsverhalten der Metalle ist der pH-Wert ein wichtiger Parameter, denn von ihm hängt es ab, ob sich auf dem Metall eine schützende Deckschicht ausbilden kann. Da wir es hier mit einer logarithmischen Größe zu tun haben, sind Korrekturmaßnahmen für das Anlagenwasser für den Nichtchemiker eher schwer einzuschätzen. Dazu ein Beispiel: Vermischt man je einen Liter Wasser (bei vergleichbarer elektrischer Leitfähigkeit) mit einem pH-Wert von 7 und pH 10, so erhält man zwei Liter Wasser mit einem pH-Wert von 9,7!
Zum Vergleich verhält sich die elektrische Leitfähigkeit im üblichen Bereich der Anlagenwässer linear, d.h., wenn wir je einen Liter Wasser mit einer Leitfähigkeit von 300 und 500 µS/cm mischen, erhalten wir zwei Liter mit einer elektrischen Leitfähigkeit von 400 µS/cm. Ursache dafür ist die logarithmische Skala, nach der sich die Konzentration mit jeder Stufe um den Faktor 10 verändert.













 Frage zum Artikel
Frage zum Artikel


